Решение задач на расчет концентрации растворов по химии
- Задачи на растворы по химии
- Как решать задачи с процентными растворами
- Концентрация растворов и способы ее выражения
- Решение задач на упаривание растворов
- Решение задач на разбавление растворов
- Решение задач на концентрирование растворов
- Решение задач на смешение растворов
- Задачи на определение процентной концентрации раствора
Смесь, состоящая из частиц растворителя, растворяемого вещества и продуктов их взаимодействия, называется раствором. Это гомогенные структуры однородной консистенции, состоящие из двух либо нескольких компонентов. Решение задач на растворы – определение их концентрации, степени растворимости веществ, условий протекания растворообразующих процессов.
Задачи на растворы по химии
Чистое вещество либо смесь нескольких компонентов, попадая в растворитель, могут проявлять свойства:
- хорошей растворимости;
- малой растворимости;
- быть нерастворимыми.
При растворении в воде образуются многочисленные атомно-молекулярные связи. Их количество зависит от коэффициента растворимости – химической величины, которая рассчитывается путем деления массы растворяемого вещества на массу растворителя.
Кроме этого, в задачах могут присутствовать массовая доля вещества, растворенного в соответствующем растворителе.
Как решать задачи с процентными растворами
Растворы с выраженной концентрацией активного (растворенного) вещества носят название процентных. В задачах по химии ставятся цели определить содержание массы растворенного вещества, массы образовавшегося либо первоначального раствора, процентного содержания вещества до или после растворения.
Растворы, о которых идет речь в задачах по химии, обладают общими свойствами:
- они однородны;
- смешивание компонентов происходит за малый отрезок времени, как и изменение их концентрации;
- в результате смешивания двух (или более) растворов с различной концентрацией, происходит не только увеличение общей массы и объема раствора, но и усреднение процентного содержания растворенного вещества.
Поэтому существуют общие принципы их решения. Так, увеличение концентрации происходит в результате упаривания (испарения растворителя), а уменьшение – разбавления. В результате смешения может наблюдаться как увеличение, так и уменьшение, в зависимости от конкретных условий задачи.
В любом случае характеристики начального и конечного продуктов будут различаться, поэтому важно, данные в условии сведения не перепутать. Для этого применяется их нумерация.
Чтобы грамотно составить алгоритм решения, часто бывает полезно использовать уравнение химической реакции относительно активного вещества либо кислоты.
Концентрация растворов и способы ее выражения
На бытовом уровне понятие концентрации раствора выражается в отношении массы растворенного вещества к массе раствора, выраженном в процентах. Однако правомерно более широкое определение, охватывающее различные способы выражения концентрации.
Концентрация раствора – количественный показатель состава активного вещества в растворе, выраженное в определенных единицах и заключенное в единице массы или объема. Выражается в долях, процентах, массовых долях, молярности, мольных долях, титрах. Из них чаще применяются молярность и мольная доля.
1. О массовой доле (\(\omega\)) идет речь в задачах, когда можно составить соотношение масс растворенного компонента и всего раствора. Для ее выражения существует формула:
\(\omega=M_{в-ва}\div M_{р-ра}\)
Выражается она в процентах либо долевых частях единицы.
2. Молярность (по-другому – молярная концентрация) или \(С\) показывает сколько молей растворяемого компонента содержится в литре раствора. Ее формула имеет вид:
\(С=n\div V\)
где \(n\) – это растворенное вещество в молях. Исходя из его значения, раствор может быть одномолярным (содержит 1 моль в 1 литре), децимолярным (0,1 моля в 1 л), сантимолярным (0,01 моль) и т.д.
3. Концентрация моляльная (обозначается \(С_х\)) – моляльность – показатель количества (n) молей растворенного компонента в 1 кг растворителя (\(M_{р-ля}\)).
\(C_x=n\div M_{р-ля}\)
4. Для определения содержания (в граммах) вещества в 1 л раствора применяется понятие «титр» (\(Т\)).
\(T=M_{в-ва}\div V_{р-ра}\)
5. Под растворимостью (\(S\)) понимают максимальную массу растворяемого вещества, способного раствориться в 100 г растворителя:
\(S=(M_{в-ва}\div M_{р-ля})\times100 {}\)
6. Коэффициент растворимости (\(K_s\)) – показатель, который определяется отношением массы вещества к массе растворителя при условии получения насыщенного раствора при обозначенной температуре:
\(K_s=M_{в-ва}\div M_{р-ля}\)
Решение задач на упаривание растворов
Выпаривание раствора происходит в результате испарения воды, что ведет за собой уменьшение общего объема и массы. В то же время масса растворенного вещества остается без изменений. Существуют случаи, когда, кроме растворителя, испаряется растворенное вещество, если оно обладает повышенной летучестью.
Пример. Водный раствор аммиака
Рассмотрим пример решения задачи на упаривание.
Условие: В наличии 800 г раствора с 15%-ной концентрацией определенного вещества. Нужно увеличить его массовую долю на 5%. Сколько г воды должно испариться?
Этапы решения:
- Какова масса вещества в первичном растворе?
\(M_в=\omega_в\times M_р=0,15×800=120\)г, где \(M_в\) - масса вещества, \(M_р\) - масса раствора
Найденное значение останется постоянным, поскольку при выпаривании изменения массы растворенного вещества не происходит. Значит M’=120г
2. \(M_р=M_в\div\omega_в= 120÷0.2=600\)г
3. Теперь можно найти массу испаренной воды:
\(M{исп\;в}=M_р-M’=800-600=200\)г
Решение задач на разбавление растворов
В результате процесса разбавления масса того вещества, которое растворено, не меняется в отличие от массы всего раствора и растворителя.
Задача
Масса имеющегося раствора NaCl 200г, его концентрация – 15%. К раствору добавлено 40г воды. Определить массовую долю NaCl в конце реакции.
Решение
1. Определение массы раствора в конце процесса:
\(M’=M_{р-ра}+M_{добH2O}=240\)г
2. Определение массы NaCl в начале процесса:
\(M_{NaCl}=(\omega_{NaCl}\times M_р)\div100\%=15\%\times200г\div100\%=30 {}\)г
В конечном растворе \(M’_ {NaCl}=M_{NaCl}\)
3. Определение массовой доли NaCl в конце процесса:
\(\omega’_{NaCl}=M_{NaCl}\div M’_р\times100\%=12,5\%\)
Решение задач на концентрирование растворов
Повышение концентрации происходит при добавлении вещества в раствор. При этом конечная масса растворенного вещества равна сумме первоначального содержимого и того, который добавлен.
Задача. Имеется 180 г раствора с 8%-ной концентрацией соли (формула NaCl). В этот раствор всыпали еще 20 г поваренной соли. Какая массовая доля NaCl получилась в конце реакции?
Решение
1. Определение окончательной массы раствора:
\(M’_р=M_р+M_{доб}=200\)г
2. Определение конечной массы NaCl:
M’=M+Mдоб
Следовательно, нужно найти \(M\) – массу в начале процесса.
\(M=(\omega_{NaCl}\times M_р)÷100%=14,4\)г
Тогда \(M’=14,4г+20г=34,4\)г
3. Определение массовой доли NaCl в конечном продукте:
\(\omega’=M’_{NaCl}\div M’_р\times100\%=17,2%\)
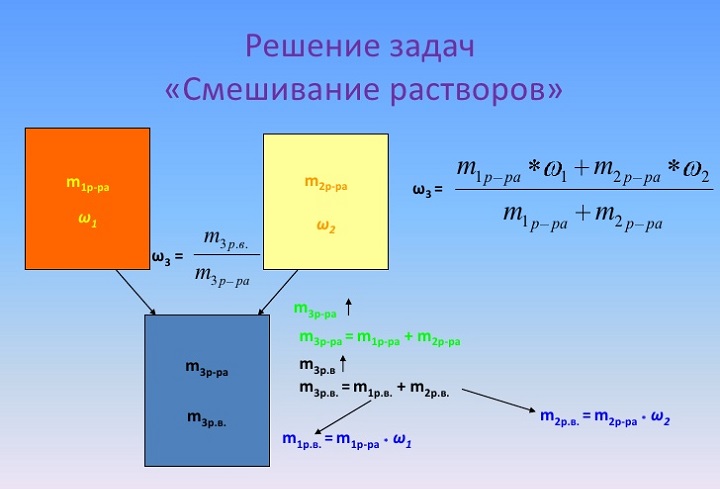
Решение задач на смешение растворов
Смешение растворов с различной концентрацией растворенного вещества происходит с соблюдением «конверта Пирсона». Это – диагональная модель, при которой нельзя складывать массовые доли, а можно – лишь массы растворенных компонентов и растворов.
Задача
Дано два раствора с массами \(M\) и \(M_1\). Массовые доли растворенного вещества обозначим соответственно \(ω\) и \(ω_1\). В конечном продукте аналогичная величина – \(ω_3\). Необходимо приготовить третий раствор с отличной от имеющихся концентраций.
Решение
1. Определение общей массы растворенного вещества:
\(M_1\omega_1+M_2\omega_2=\omega_3(M_1+M_2)\)
2. Математические действия:
\(M_1(\omega_1-\omega_3)=M_2=(\omega_3-\omega_2)\)
\(M_1\div M_2=(\omega_3-\omega_2)\div(\omega_1-\omega_3)\)
Следовательно, согласно этому математическому выражению, и нужно взять соотношение растворов.
Задачи на определение процентной концентрации раствора
Задача 1
Какая процентная концентрация раствора \(KNO_3\), если нормальная равна \(0,2\) моль/л. Плотность равна \(1\) г/мл.
Решение:
1. Определение массы раствора объемом \(1000\) мл:
\(M=\rho\times V=1\times1000=1000\)г
2. Составление и решение следующей пропорции:
\(20,0\)г \(KNO_3\) - \(1000\) г раствора
\(Х_г\) - \(100\) г раствора
\(Х=2,02\) г или \(ω=2,02%\)
Задача 2
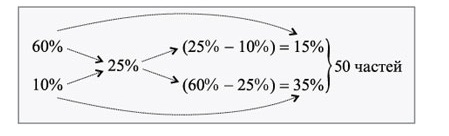
Нужно приготовить \(300\) г 25%-ного раствора соли, имея 60%-ный и 10%-ный. Сколько нужно взять таких компонентов (m1 и m2)?
Для решения применим правило Креста:
1. Определение веса одной из 50-ти частей образуемого раствора:
\(300\div5=6\)
2. Определение массы каждой части \(m_1\) и \(m_2\):
\(m_1=6\times15=90\)
\(m_2=6\times35=210\)
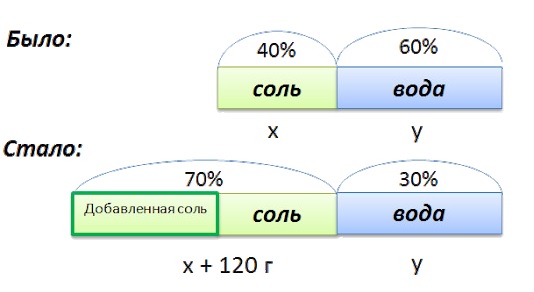
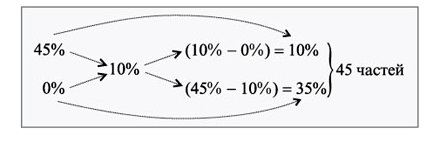
Задача 3
Используя 250г 45%-ного раствора соли, нужно понизить его концентрацию до 10%. Сколько воды необходимо использовать?
Концентрация соли в воде, используемой в качестве добавки, равна 0.
По методу креста образуется 45 частей раствора:
Решение
1. Масса одной части первичного раствора равна: \(250\div10=25\)г
2. Определение массы воды, что необходима: \(25\times35=875\)г
С целью проверки можно выполнить следующие действия:
1. Определение массы конечного продукта-раствора:
\(875+25=1125г\)
2. Для исходного раствора действует пропорция:
В 250г 40%-ного р-ра содержится Хг соли
в 100 г – 45г
Отсюда Х=112,5 г соли
3. Определение конечной концентрации раствора:
1125 г раствора – 112,5 соли
100г – Х
Х=10г или 10%
Следовательно, нужно взять 875 г воды.
Решать задачи на растворы – интересное занятие! Знание основных закономерностей будет полезно с теоретической и практической точек зрения. Однако бывают случаи, когда нужно быстро сдать контрольную либо перепроверить собственные решения. Тогда можно обратиться на сайт ФениксХелп.
Понравилась статья?
Подпишитесь на наш блог и получайте наши статьи первым!
Или подписывайтесь на нас в соцсетях:
Заметили ошибку? Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так



Бесплатно отвечаем на ваши вопросы. Задайте свой вопрос и получите ответ от профессионального преподавателя. Выберите лучший ответ.
Вопросы могут задавать только авторизованные пользователи. Войти
Евгений Беляев
14.02.2022 12:49
Имеется некоторый раствор с плотностью 1300 Добавили в него 10 л. воды(дистиллированной) плотность этого раствора стала 1290. Найти объем исходного раствора( желательно подробно описать выход на формулу)
21.01.2022 16:01
Сколько нужно взять едкого натра, чтобы приготовить 200 мл 0,1 М раствора едкого натра NaOH. Решение: Прежде; всего вычислим вес грамм-молекулы едкого натра NaOH. 23 + 16 + 1 = 40 г. Так как раствор 0,1 М, то в 1 л раствора содержится 0,1 грамм-молекулы NaOH, т. е. 4 г, а в 200 мл или в 0,2 л, раствора будет содержаться неизвестное количество NaOH. Составляем пропорцию: в 1 л 0,1 М раствора — 4 г NaOH » 0.2 » » — х » NaOH Отсюда 1 : 0,2 = 4 : x x = (4 · 0,2) : 1 = 0,8 г. т. е. для приготовления 200 мл 0,1 М раствора нужно 0,8 г NaOH. https://znaesh-kak.com/x/s/концентрация-раствора правильное решение или нет подскажите