В состав каких органических соединений входит азот
В этом материале расскажем вкратце о важнейших органических соединениях, без которых невозможно представить жизнь человека на планете. В их состав входит один из самых распространенных химических элементов — азот.
Азотсодержащие органические соединения
Азотсодержащие органические соединения, как понятно из названия, содержат в своей молекуле хотя бы один атом азота. Для них характерны связи азот-углерод и углерод-водород.
Количество в природе таких соединений очень велико. Это связано со свойством углерода образовывать цепочки из атомов. Связи между атомами углерода могут быть одинарными и кратными, причем чем больше будет кратность, тем выше энергия связи (стабильность) и меньше ее длина.
Благодаря высокой валентности (4) и способности создавать кратные связи, можно увидеть различные структуры органических соединений: плоские, объемные и линейные.
Характерные физические и химические свойства
Все органические соединения, в том числе содержащие азот, обладают общими важными отличительными свойствами по отношению к другим химическим соединениям.
- Явление изомерии, когда соединения с одинаковым составом и одной молекулярной массой носят разные физико-химические свойства. Такие вещества в химии называются «изомеры».
- Явление гомологических рядов, когда соседние соединения отличаются на одну группу атомов. Чаще всего это \(CH_2\), которая называется метиленовой группировкой. Гомологи обладают качественно одинаковыми свойствами и ведут себя более или менее одинаково по отношению к отдельным реактивам. Прослеживаются закономерности в изменении физических свойств членов ряда.
Рассмотрим теперь свойства отдельных классов соединений с азотом и его самого как химического элемента.
Азот (N)
Название этому элементу дал ученый А. Лавуазье и в переводе оно имеет значение «безжизненный» — было установлено, что мыши, помещенные в емкость с азотом погибают. Азот входит в состав воздуха (78% по объему), а также во многие органические и неорганические вещества. В периодической системе Менделеева принадлежит к 15-й группе второго периода. Атомный номер 7. В подгруппу азота, которая называется пниктиды или пниктогены входят фосфор, мышьяк, сурьма, висмут и искусственно полученный радиоактивный элемент московий.
По физическим свойствам азот бесцветный двухатомный газ без вкуса и запаха, в воде малорастворим. Плотность \(1,2506\;кг/м^3\) (при н.у.). В жидком состоянии плотность азота \(808\;кг/м^3\) . Температура кипения - \(195,8\;C^\circ\) . При \(-209,86\;C^\circ\) переходит в твердое состояние. Поглощает при контакте с воздухом из него кислород.
Химические свойства: инертен. Из-за этого является средой для разных производственных реакций. Реагирует на комплексные соединения переходных металлов. Со сложными веществами в реакцию не вступает.
В свободном состоянии молекула азота имеет вид \(N_2\).
5. Примечание
При повышенном атмосферном давлении азот токсичен, а большинство его соединений способны нанести вред здоровью, поэтому он относится ко второму классу опасности.
Амины
Если в их молекуле небольшое количество атомов углерода, то они весьма похожи по свойствам на аммиак — ядовитые газы с резким и неприятным запахом, хорошо растворимые в воде. Остальные низшие амины — жидкости.
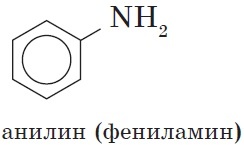
Простейший представитель — анилин.
Особенность аминов в том, что у атома азота есть неподеленная электронная пара, поэтому они проявляют химические свойства оснований.
Первичные и вторичные амины могут создавать водородные связи, поэтому их температуры кипения по сравнению с соединениями, имеющими ту же молекулярную массу, но не образующих водородные связи, намного выше.
Аминокислоты имеют две функциональные группы — аминогруппу \(NH_2\) и карбоксильную группу \(COOH\), которые взаимно влияют друг на друга, благодаря чему аминокислоты являются амфотерными органическими соединениями, проявляющими себя со щелочами как кислоты, а с сильными кислотами как основания.
По своим физическим свойствам многие аминокислоты имеют сладкий вкус, некоторые могут быть горькими или безвкусными. Это кристаллы, имеющие большие температуры плавления (выше \(200^\circ C\)) и лучше растворяющиеся в воде, чем в органических растворителях.
В живой природе они выступают как буферные вещества, поддерживающие нужную концентрацию ионов водорода. Кроме природных аминокислот бывают еще синтетические. Незаменимые аминокислоты не производятся человеческим организмом и должны поступать с продуктами. Если этого не случится, то в здоровье может произойти сбой.
Белки или протеины по своим химическим свойствам амфотерные электролиты. Их главная особенность в том, что при определенном pH число положительных и отрицательных зарядов в молекуле одинаково.
Физически это чаще белые или бесцветные вещества с твердой кристаллической или аморфной структурой, с разной растворимостью.
Реакции, характерные для протеинов.
- Гидратация, т.е. связывание воды, когда белки проявляют гидрофильные свойства: набухают, а масса и объем становятся больше.
- Денатурация, т.е. изменение структуры под влиянием внешних факторов.
- Пенообразование, т.е. способность образовывать высококонцентрированные системы «жидкость — газ» или пены.
- Горение. В результате образуются вода, азот и углекислый газ.
- Цветные реакции, в том числе:
— ксантопротеиновая, при которой происходит взаимодействие ароматических и гетероатомных циклов в молекуле белка с концентрированной азотной кислотой, сопровождающееся появлением желтой окраски;
— биуретовая, т.е. взаимодействие слабощелочных растворов белков с раствором сульфата меди (II) с образованием комплексных соединений между ионами \(Cu2+\) и полипептидами.
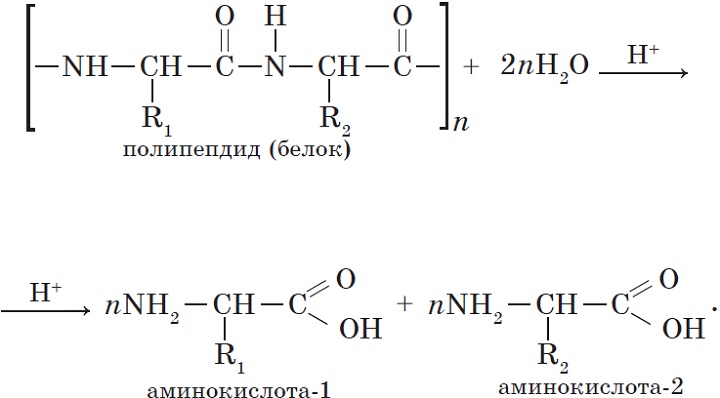
- Гидролиз:
Классификация азотосодержащих соединений
Амины
Производные аммиака \(NH_3\\\\\) , в молекуле которого атомы водорода (один, два или три) замещены на углеводородные радикалы.
- \(R-NH_2\) (первичные);
- \(R-NH-R^´\) (вторичные);
- \(R-N(-R´)-R´´\) (третичные).
По характеру углеводородного радикала бывают:
- алифатические;
- алициклические;
- ароматические;
- гетероциклические;
- смешанные.
Амиды
\(R(CONH_2)\;{{}}_1\\\\\)
Нитрилы
\(R-CN\\\\\)
Аминокислоты
\(NH_{2\;}-CHR-COON_1\\\\\)
Пептиды
\(R(C=O)(NH)R_1\\\\\)
Значение и применение азот-органических соединений
Соединения, включающие в себя азот, являются одними из составляющих живой материи и их значение трудно переоценить. Азот входит в состав:
- белков,
- аминокислот,
- нуклеиновых кислот,
- гемоглобина,
- хлорофилла,
- гормонов,
- алкалоидов
- некоторых липидов, углеводов и др.
Азот-органические соединения способны к разнообразным превращениям и образованию сложных молекулярных структур, которыми занимается наука биология. Это обуславливает переход от химической формы движения материи к биологической, т.е. от неживого вещества к живому.
Использование азотсодержащих соединений широко в повседневной жизни: в технике, промышленности, медицине, сельском хозяйстве и конечно в быту. Они входят в состав лекарств, органических удобрений, различных полимерных материалов, красителей и многого другого.
При гниении и расщеплении азотсодержащей органики могут образовываться целые залежи полезных ископаемых, например чилийской селитры.
Если у вас остались вопросы, то всегда можно обратиться в службу для студентов ФениксХелп за помощью и консультацией.
Понравилась статья?
Подпишитесь на наш блог и получайте наши статьи первым!
Или подписывайтесь на нас в соцсетях:
Заметили ошибку? Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Нашли ошибку?
Текст с ошибкой:
Расскажите, что не так

Бесплатно отвечаем на ваши вопросы. Задайте свой вопрос и получите ответ от профессионального преподавателя. Выберите лучший ответ.
Вопросы могут задавать только авторизованные пользователи. Войти